Σήμερα κανείς δεν αμφισβητεί την ύπαρξη των ατόμων και όλοι οι επιστήμονες έχουν αντιληφθεί ότι η ατομική δόμηση αποτελεί τον ακρογωνιαίο λίθο των φυσικών επιστημών και τη βάση των τεχνολογικών εξελίξεων. Παρόλα αυτά, οι ιδέες μας για το τι είναι ένα άτομο είναι εκπληκτικά πρόσφατες. Με την πάροδο του χρόνου, μια σειρά από επιστήμονες πρόσθεταν από ένα κομμάτι για να ολοκληρωθεί η σημερινή φανταστική εικόνα και η κομψή αντίληψη της ατομικής θεωρίας.
Το ατομικό πρότυπο του Bohr είναι πιθανώς το μοντέλο με το οποίο είστε πιο εξοικειωμένοι, δεδομένου ότι εξακολουθεί να είναι το μοντέλο του ατόμου που βλέπουμε πιο συχνά, παρόλο που δεν ισχύει σήμερα. Σημαντικός στη δημιουργία παρανοήσεων είναι και ο ρόλος των σχολικών βιβλίων. Η αφηρημένη και συμβολική φύση των κβαντομηχανικών εννοιών αλλά και η προσπάθεια για απλοποίησή τους, καθιστούν το έδαφος πρόσφορο για παρανοήσεις.
- Πληροφορίες
- Βιοφυσική

Τα βασικά μοντέλα που προτάθηκαν για το άτομο, και πώς άλλαξαν με το πέρασμα του χρόνου:
5ος - 4ος π.Χ. αιώνας
Λεύκιππος & ΔημόκριτοςΗ γέννηση της ιδέας του ατόμου έγινε στην Αρχαία Ελλάδα
Η ατομική αντίληψη διατυπώθηκε ως φιλοσοφική δοξασία από το Λεύκιππο και το μαθητή του Δημόκριτου: ο κόσμος είναι το κενό και τα άτομα. Περιέγραψαν την ιδέα ότι όλα αποτελούνται από άτομα, αόρατες και αδιαίρετες σφαίρες της ύλης άπειρου τύπου και αριθμού.
Η λέξη «άτομο» προέρχεται από την αρχαία ελληνική «ἄτομον», ουδέτερο του επιθέτου ἄτομος < ἀ- στερητικό + τέμνω και σημαίνει αυτός που δεν μπορεί να διαιρεθεί.
Τα θεμέλια είχαν χτιστεί, όμως η θεωρία του Δημόκριτου θα καταπολεμηθεί από τον Πλάτωνα, τον Αριστοτέλη και τους μαθητές του και θα πέσει στην αφάνεια για τεράστιο χρονικό διάστημα, μέχρι και τον 19ο αιώνα.
Ήταν μια μακρά αναμονή, ωστόσο,
1803
John DaltonΗ ύλη είναι ασυνεχής και αποτελείται από άτομα που είναι αδύνατο να διαιρεθούν

Ο Άγγλος χημικός συνέχισε τις ιδέες των Αρχαίων Ελλήνων και έδωσε ένα πιο επιστημονικό περιεχόμενο στην ατομική αντίληψη: ο κόσμος αποτελείται από μικροσκοπικά, στοιχειώδη, άτμητα σωματίδια που είναι άφθαρτα και αναλλοίωτα. Σήμερα, βέβαια γνωρίζουμε ότι τα άτομα δεν είναι αδιαίρετα. Αποτελούνται από υποατομικά σωματίδια.
Επίσης, είπε ότι τα άτομα ενός δεδομένου στοιχείου είναι πανομοιότυπα μεταξύ τους.
Αυτό είναι κάτι που ισχύει ακόμα, αν εξαιρεθούν τα ισότοπα στοιχείων, τα οποία διαφέρουν στον αριθμό των νετρονίων.
Η περιγραφή της ατομικής θεωρίας από τον Dalton ήταν μια αρχή, αλλά δεν μας είπε ακόμη πολλά για τη φύση των ίδιων των ατόμων.
Αν και υπήρξαν κάποιες απόπειρες να προσδιοριστούν τα άτομα, ακολουθήθηκε ακόμη ένα άλλο, μικρότερο χρονικό διάστημα όπου η γνώση μας για τα άτομα δεν προχώρησε τόσο πολύ. Υπήρξαν μάλιστα επιστήμονες που δήλωναν: «Σε μερικές δεκαετίες το μόνο μέρος που θα μπορεί να βρει κανείς τα άτομα θα είναι στα σκονισμένα ράφια των βιβλιοθηκών».
Μόλις στην αρχή του 20ου αιώνα άρχισε να γίνεται κάποια πρόοδος στην διερεύνηση της ατομικής δομής.
1897
J.J. ThomsonΤα άτομα δεν είναι αδιαίρετα. Ανακάλυψε το ηλεκτρόνιο και προσδιόρισε τη φύση και το λόγο φορτίο προς μάζα του ηλεκτρονίου.
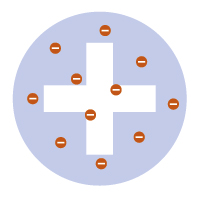
Το Μοντέλο του «Σταφιδόψωμου»
Για να γίνει η ανακάλυψη του ηλεκτρονίου έπρεπε να προηγηθεί η ανακάλυψη και μελέτη των καθοδικών ακτίνων από τους J. Plucker το 1859 και W. Crook το 1879 (σωλήνες Crookes). Στη δεκαετία του 1870, οι επιστήμονες άρχισαν να εξετάζουν από τι είναι φτιαγμένα τα υλικά χρησιμοποιώντας σωλήνες υψηλού κενού, βασικά γεμισμένων με αέριο σωλήνων με ηλεκτρόδια σε κάθε άκρο, που εκπέμπουν φως όταν περνάει ηλεκτρικό ρεύμα. Επειδή αυτό το φως παρήχθη αρχικά από αρνητικό ηλεκτρόδιο ή κάθοδο, ονομάστηκε καθοδική ακτίνα και είχε αρνητικό φορτίο.
1886 E.Goldstein (Γερμανός): Ανακάλυψε στους σωλήνες των καθοδικών ακτίνων δέσμη θετικά φορτισμένων σωματιδίων, που ονόμασε διαυλικές ή θετικές ακτίνες. Διαπίστωσε ότι οι σωλήνες εκπέμπουν επίσης φως από το θετικό ηλεκτρόδιο. Βασικά, οι ακτίνες αυτές κινούνταν ευθύγραμμα από την άνοδο προς την κάθοδο, δηλαδή αντίθετα προς τις καθοδικές ακτίνες, πράγμα που σήμαινε ότι πρέπει επίσης να υπάρχει ένα θετικό φορτίο στην ύλη. Ο Goldstein δεν κατάλαβε πλήρως τι είχε ανακαλύψει. Βέβαια, ούτε το αρνητικό φορτίο στις ακτίνες καταλάβαιναν οι επιστήμονες τι ήταν.
Τότε, ο Άγγλος J.J. Thomson με πειράματα μέτρησε πόση θερμότητα παράγουν οι καθοδικές ακτίνες και παρατήρησε ότι εκτρέπονται από ηλεκτρικό και μαγνητικό πεδίο και μπορούν να κινούν ένα φτερωτό τροχό.
Προς έκπληξη του, υπολογίζοντας τη μάζα των ακτίνων, είδε ότι ήταν περίπου χίλιες φορές ελαφρύτερη από ένα υδρογόνο, το οποίο ήταν το μικρότερο κομμάτι ύλης που γνώριζαν εκείνη την εποχή.
Κατέληξε στο συμπέρασμα ότι οι "ακτίνες" δεν ήταν καθόλου ακτίνες, αλλά, πολύ μικρά αρνητικά φορτισμένα σωματίδια. Είχε ανακαλύψει το ηλεκτρόνιο και έδειξε ότι τα άτομα δεν ήταν αδιαίρετα, αλλά είχαν μικρότερα συστατικά μέρη. Το 1904, πρότεινε το μοντέλο του ατόμου με βάση τα ευρήματά του.
Ατομικό πρότυπο Thomson: Το Μοντέλο του «Σταφιδόψωμου»
Το άτομο γενικά έχει ουδέτερο φορτίο, όμως αποτελείται τόσο από αρνητικά όσο και από θετικά στοιχεία. Ποια είναι η οργάνωση του ατόμου;
Σύμφωνα με το μοντέλο του Thompson, τα ηλεκτρόνια είναι διάσπαρτα σε μία σφαίρα θετικού φορτίου, όπως περίπου οι σταφίδες στο σταφιδόψωμο. Στο θετικά φορτισμένο «ψωμί» είναι ελεύθερα να κινηθούν τα ηλεκτρόνια «σταφίδες», ενώ μια λεπτή ισορροπία μεταξύ της έλξης τους προς το κέντρο του θετικού φορτίου και της άπωσης μεταξύ τους, τα κρατά συγκεντρωμένα στην ίδια περιοχή.
1911
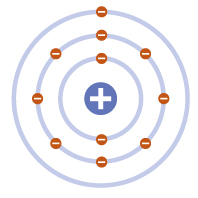
Ernest RutherfordΑτομικό Πρότυπο Rutherford: το Ασταθές Πλανητικό Πρότυπο

Ο Νεοζηλανδός φυσικός Ernest Rutherford, ένας από τους μαθητές του Thomson, επινόησε ένα πείραμα για τη διερεύνηση του εσωτερικού των ατόμων, ελπίζοντας να επιβεβαιώσει το μοντέλο του Thomson, αλλά κατέληξε να κάνει ακριβώς το αντίθετο.
Το πείραμα των Geiger (βοηθός του Rutherford) και Marsden (προπτυχιακός φοιτητής) που σχεδίασε ο Rutherford περιελάμβανε την πυροδότηση θετικά φορτισμένων σωματιδίων α (πυρήνες He, προϊόν ραδιενεργού διάσπασης) σε ένα λεπτό φύλλο χρυσού (Au). Τα σωματίδια άλφα, δεν γνώριζε πραγματικά τι ήταν, μόνο ότι ήταν θετικά φορτισμένα και πάρα πολύ μικρά. Ο χρυσός επιλέγει λόγω της υψηλής του ελατότητας. Σύμφωνα με το μοντέλο του Thomson που έδειχνε ότι το θετικό φορτίο διαχέεται σε ολόκληρο το άτομο, η δέσμη των σωματιδίων α διερχόμενη μέσω των ατόμων, αναμένονταν να περάσει μέσα από το φύλλο χρυσού ή να εκτραπεί καθόλου έως ελάχιστα.
Και όντως, τα περισσότερα από τα σωματίδια άλφα πέρασαν από το φύλλο με μικρή ή καθόλου εκτροπή. Ωστόσο, πάρα πολύ λίγα εκτρέπονταν σε μεγάλες γωνίες και ακόμη λιγότερα επέστρεφαν πίσω.
Αυτό ήταν εντελώς απροσδόκητο. Όπως είπε ο ίδιος ο Rutherford, "Ήταν τόσο απίστευτο όσο το να ρίχνετε βλήμα σε ένα κομμάτι χαρτί και αυτό να επιστρέφει και να σας χτυπάει".
Η μόνη πιθανή εξήγηση ήταν ότι το θετικό φορτίο του ατόμου, το φορτίο που θα απωθούσε ένα άλφα σωματίδιο, και πρακτικά όλη η μάζα του δεν απλωνόταν σε όλο το άτομο, αλλά ήταν συγκεντρωμένο σε ένα μικρό, πυκνό κέντρο: τον πυρήνα.
Επειδή τα περισσότερα από τα σωματίδια άλφα διαπέρασαν τα άτομα χωρίς να εκτραπούν, ο Rutherford κατέληξε στο συμπέρασμα ότι το μεγαλύτερο μέρος του υπόλοιπου ατόμου είναι κενός χώρος και είχε δίκιο.
Το 1911 ο Rutherford πρότεινε ένα μοντέλο όπου τα ηλεκτρόνια περιστρέφονται κυκλικά γύρω από τον θετικά φορτισμένο πυρήνα, όπως οι πλανήτες γύρω από τον ήλιο. Τα ηλεκτρόνια φέρουν τόσο αρνητικό φορτίο, όσο απαιτείται για την ηλεκτρική ουδετερότητα του ατόμου.
Ενώ αυτό το μοντέλο ήταν βελτιωμένο, δεν εξήγησε γιατί τα ηλεκτρόνια παρέμεναν σε τροχιά γύρω από τον πυρήνα.
Κλασική φυσική Vs Κβαντική Φυσική
Λίγα λόγια…
Κλασική Φυσική
Κλασική Φυσική ονομάζουμε ένα σύνολο αρχών που αναπτύχθηκε κυρίως στη διάρκεια του 18ου και 19ου αιώνα και προσεγγίζει με εξαιρετικό τρόπο τη συμπεριφορά των σωμάτων σε μακροσκοπική κλίμακα. Στην Κλασική φυσική ο κόσμος δομείται από ύλη που συγκροτείται από άτομα και ακτινοβολία που είναι κύματα. Βασικές αρχές της είναι η αρχή του ντετερμινισμού (το παρόν καθορίζει το μέλλον) και αρχή της αιτιότητας (το κάθε φαινόμενο έχει το αίτιο του). Επιπλέον, δεν υπάρχει περιορισμός όσον αφορά την τιμή της ενέργεια που μπορεί να έχει ένα σύστημα.
Το 1900 υπήρχε η αντίληψη ότι η φυσική έχει σχεδόν ολοκληρωθεί. Υπήρχαν βέβαια λίγα κενά, για παράδειγμα, η δομή των ατόμων και των μορίων. Όμως πολλοί φυσικοί θεωρούσαν τα θεματάκια αυτά ασήμαντες λεπτομέρειες. Λίγα χρόνια αργότερα όμως, αυτά τα «κενά» θα αποδειχτούν θεμελιώδη, γεννώντας μία Νέα Φυσική, τη Κβαντομηχανική.
Κβαντομηχανική
Η Κβαντομηχανική βασίζεται στην αντίληψη ότι η ενέργεια που εκπέμπει ή απορροφά ένα σώμα είναι ακέραιο πολλαπλάσιο μιας ελάχιστης ποσότητας (κβάντο ενέργειας) και ότι δεν υπάρχει σαφής διάκριση μεταξύ σωματιδιακής και κυματικής φύσης. Η Κβαντομηχανική ερμηνεύει το μικροσκοπικό κόσμο, χωρίς να αδιαφορεί για το μακρόκοσμο.
Η Κβαντική Θεωρία διατυπώθηκε από τον Max Plank το 1900, προκειμένου να ερμηνευθούν μια σειρά πειραματικών δεδομένων που ήταν αδύνατον να ερμηνευτούν με τις αρχές της Κλασικής Φυσικής.
Αξίζει να σημειωθεί ότι ο πρόεδρος του τμήματος φυσικής στο πανεπιστήμιο του Μονάχου προσπάθησε να αποτρέψει τον Max Plank να σπουδάσει φυσική, λέγοντας του «ότι είχε να δώσει η φυσική το έχει δώσει, ασχολήσου με κάτι άλλο». Ευτυχώς ο Max Plank δεν άκουσε τη συμβουλή του.
Η εφαρμογή της Κβαντομηχανικής στα χημικά συστήματα (π.χ. άτομα, μόρια ή ιόντα) δημιούργησε τον ιδιαίτερο επιστημονικό κλάδο την Κβαντοχημεία.
1913
Niels BohrΑτομικό Πρότυπο Bohr: το Σταθερό Πλανητικό Μοντέλο
Το 1913 μπαίνει ο Niels Bohr. Το ίδιο έτος που ο Rutherford δημοσίευσε τα αποτελέσματα του πειράματος του, ο Δανός φυσικός Bohr ταξίδεψε στην Αγγλία για να συνεργαστεί μαζί του. Προσπάθησε να λύσει τα προβλήματα στο μοντέλο του Rutherford και να ερμηνεύσει τη σταθερότητα του ατόμου αλλά και τα αποτελέσματα της ατομικής φασματοσκοπίας. Να βρει δηλαδή πως συμπεριφέρονται τα ηλεκτρόνια.
Ο Bohr, χωρίς να απαρνιέται τις αρχές της Κλασικής Φυσικής, συνειδητοποίησε ότι οι μαθηματικές αρχές του Max Plank και Albert Einstein θα μπορούσαν να εφαρμοστούν στο ατομικό μοντέλο. Υπολόγισε την αναλογία των σωματιδίων άλφα που διέρχονταν από το φύλλο χρυσού, εκείνων που εκτρέπονταν και εκείνων που γύριζαν πίσω για να προβλέψει τις πιθανότερες θέσεις των ηλεκτρονίων στο άτομο.
Όρισε 2 αυθαίρετες συνθήκες:
Μηχανική συνθήκη
Τα ηλεκτρόνια περιστρέφονται γύρω από τον πυρήνα σε ορισμένες κυκλικές τροχιές. Κάθε επιτρεπόμενη τροχιά έχει καθορισμένη ενέργεια, δεν μπορεί να πάρει μια οποιαδήποτε τιμή, είναι δηλαδή κβαντισμένη.
Οπτική συνθήκη
Τα ηλεκτρόνια μπορούν να κινούνται (μεταπηδούν) μεταξύ αυτών των ενεργειακών επιπέδων, αλλά το κάνουν είτε απορροφώντας (διέγερση) είτε εκπέμποντας (αποδιέγερση) ενέργεια. Αυτή η μετάβαση του ηλεκτρονίου από τροχιά σε τροχιά, είναι γνωστή ως κβαντικό άλμα.
Το μοντέλο του ατόμου του Bohr, που μοιάζει με πλανητικό σύστημα, είναι λανθασμένο. Τα άτομα δε μοιάζουν με πλανήτες. Το ότι δουλεύει καλά στη περίπτωση του ατόμου του υδρογόνου και ερμηνεύει με καταπληκτική επιτυχία τα φάσματα εκπομπής του ήταν μια ατυχής-ευτυχής συγκυρία. Το μοντέλο του αδυνατούσε να ερμηνεύσει το φάσμα εκπομπής των πολυηλεκτρονιακών ατόμων.
Αξίζει να σημειώσουμε την απόγνωση του Schrodinger (πατέρα της Κβαντομηχανικής) στην προσπάθεια του να ερμηνεύσει το ατομικό πρότυπο του Bohr: «Αν πρόκειται να μείνει όλη αυτή η καταραμένη ιστορία των κβαντικών αλμάτων, πρέπει να λυπάμαι που έμπλεξα με την Κβαντική Θεωρία».
Η πρόταση του Bohr αντιμετώπιζε προβλήματα, των οποίων οι ακριβείς λόγοι είναι λίγο πιο περίπλοκοι από ό, τι πρόκειται να συζητήσουμε εδώ, γιατί μπαίνουμε στο περίπλοκο κόσμο της κβαντικής μηχανικής, και όπως είπε ο ίδιος ο Bohr: "Αν η κβαντική μηχανική δε σας έχει σοκάρει, δεν την έχετε καταλάβει ακόμα". Με άλλα λόγια, τα πράγματα γίνονται λίγο περίεργα...
Το πλανητικό μοντέλο του ατόμου, συμπεριλαμβανομένου και του ατομικού προτύπου Bohr, όπου ήθελε τη κίνηση του ηλεκτρονίου σε καθορισμένη κυκλική τροχιά, προϋπόθετε επακριβή γνώση της θέσης και ταχύτητας, παραβίαζε την Αρχή αβεβαιότητας που θα οριστεί μερικά χρόνια αργότερα από τον Heisenberg, οπότε αυτομάτως θα καταρριφθεί.
Παρά το γεγονός ότι η πλανητική θεωρία του ατόμου του Bohr είναι λανθασμένη, προσέφερε κάτι πολύ σημαντικό, αποτέλεσε την απαρχή για την ανάπτυξη της σύγχρονης (κβαντομηχανικής) αντίληψης για την ατομική δόμηση.
Διακρίνουμε, λοιπόν, δύο περιόδους ανάπτυξης της Κβαντικής Θεωρίας: την παλαιά κβαντομηχανική που συνδέεται με το πλανητικό μοντέλο του Bohr και τη νέα κβαντομηχανική που συνδέεται κυρίως με τις εργασίες των Heisenberg και Schrodinger.
«Οι παραδοχές του Bohr θα μπορούσαν να χαρακτηριστούν ως μπάλωμα στο κλασικό οικοδόμημα της Φυσικής. Μπάλωμα χρήσιμο και κυριολεκτικά επιβεβλημένο, αλλά μπάλωμα αταίριαστο με το κλασικό οικοδόμημα, που χαλάει την αρχιτεκτονική ομορφιά του και γεννάει σκέψεις για ριζοσπαστικές επαναστατικές αλλαγές, για επικείμενα γκρεμίσματα και ξαναχτισίματα.» Ε. Ν. Οικονόμου
1924
Louis de BroglieΥλοκυματικός δυισμός της ύλης
Κλασικά, όπως γίνεται και στα παραμύθια, τη κατάσταση ήρθε να σώσει το πριγκιπόπουλο.
Μια φορά κι έναν καιρό, ο Γάλλος πρίγκιπας, Louis de Broglie, κάνοντας διδακτορικό στη φυσική κατέληξε στην εξωφρενική για την εποχή εκείνη αντίληψη ότι το ηλεκτρόνιο είναι κυματοσωματίδιο.
Ήδη υπήρχε η ιδέα ότι η ηλεκτρομαγνητική ακτινοβολία είχε σωματιδιακές ιδιότητες. Δηλαδή, παρουσιάζει διττή φύση κύματος-σωματιδίου. Ο Louis de Broglie επέκτεινε την έννοια του δυισμού αναπτύσσοντας τη θεωρία ότι κάθε κινούμενο μικρό σωματίδιο, π.χ. ηλεκτρόνιο, πρωτόνιο παρουσιάζει διττή φύση, σωματιδίου και κύματος.
Ούτε ο ίδιος ο Louis de Broglie δε μπορούσε να εξηγήσει την κυματική συμπεριφορά του ηλεκτρονίου «Η θεωρία μου αποτελεί ένα τυπικό μοντέλο του οποίου το φυσικό περιεχόμενο δεν είναι καθορισμένο».
Η εξεταστική επιτροπή του διδακτορικού βρισκόταν σε σύγχυση. Ζήτησε λοιπόν τη γνώμη του Einstein. Η απάντηση του ήταν ενθαρρυντική «Μπορεί η θεωρία να δείχνει τρελή, αλλά είναι πράγματι βάσιμη».
Σύντομα, η ιδέα του κυματικού χαρακτήρα του ηλεκτρονίου άρχισε να διαδίδεται. Το 1927 επαληθεύτηκε πειραματικά από τους Αμερικανούς φυσικούς C.J Davinson και L.H. Germer και λίγο αργότερα από τον G.P. Thomson (γιο του J.J. Thomson που ανακάλυψε το ηλεκτρόνιο).
Και όπως γίνεται σε όλα τα παραμύθια έτσι και εδώ είχαμε happy end. Το πριγκιπόπουλο ήταν ο πρώτος επιστήμονας που έλαβε Nobel για τη διδακτορική του διατριβή.
1926
Erwin SchrödingerΕισαγωγή της κυματικής εξίσωσης και του ατομικού κβαντομηχανικού μοντέλου

Ο Αυστριακός φυσικός Erwin Schrödinger, με βάση τη θεωρία του De Broglie, έλυσε μια σειρά μαθηματικών εξισώσεων ώστε να καταλήξει σε ένα μοντέλο για τις κατανομές των ηλεκτρονίων σε ένα άτομο. Οι κυματοσυναρτήσεις που προκύπτουν από τη λύση της εξίσωσης Schrödinger ονομάζονται ατομικά τροχιακά και είναι περιοχές όπου είναι πολύ πιθανότερο να βρεθεί ένα ηλεκτρόνιο. Ονομάστηκαν τροχιακά, προς τιμήν του Bohr που εισήγαγε τον όρο τροχιά, χωρίς όμως αυτό να σημαίνει ότι έχει καμία σχέση ο όρος τροχιά με τον όρο τροχιακό.
Στο σύγχρονο μοντέλο, τα κβαντικά άτομα συχνά σχεδιάζονται ως νέφη με την ένταση του χρώματος να αντιπροσωπεύει όχι μεμονωμένα ηλεκτρόνια, αλλά την πιθανότητα να βρεθεί ένα ηλεκτρόνιο σε οποιαδήποτε συγκεκριμένη θέση.
1927
Werner HeisenbergΑρχή της αβεβαιότητας του Heisenberg
Η ανακάλυψη της κυματοσωματιδιακής φύσης της ύλης οδήγησε στην Αρχή της αβεβαιότητας του Heisenberg (1927), έναν από τους ακρογωνιαίους λίθους της κβαντικής μηχανικής, που δηλώνει ότι δεν μπορούμε να γνωρίζουμε ταυτόχρονα την ακριβή θέση και την ορμή ενός ηλεκτρονίου.
Στη κλασική Νευτώνια Μηχανική τα σφάλματα προσδιορισμού θέσης και ορμής ενός σωματιδίου είναι αμελητέα, κατά συνέπεια μπορούμε να προσδιορίσουμε τη τροχιά που διαγράφει.
Η Αρχή της Αβεβαιότητας δεν έγινε αμέσως και από όλους αποδεκτή διχάζοντας τους επιστήμονες. Στο ένα στρατόπεδο τάχτηκαν επιστήμονες, όπως ο Bohr, που ανέλαβαν την υπεράσπισή της, ενώ στο αντίθετο στρατόπεδο τάχτηκαν ντετερμινιστές, καθώς η αντίληψη αυτή κλόνιζε την αρχή της αιτιότητας. Ένας από αυτούς που προσπάθησε να τη διαψεύσει ήταν ο Einstein «Πιστεύετε σε ένα Θεό που παίζει ζάρια, ενώ εγώ σε πλήρη τάξη και νομοτέλεια του αντικειμενικού κόσμου… Ακόμα και η αρχική μεγάλη επιτυχία της Κβαντικής Θεωρίας δε με κάνει να πιστεύω σε ένα πιθανοκρατικό Κόσμο, αν και ξέρω καλά ότι οι νεότεροι συνάδελφοί αποδίδουν την εμμονή μου σε γεροντική άνοια».
Η αποδοχή του κυματικού χαρακτήρα των ηλεκτρονίων, με βάση την αρχή του δυισμού της ύλης του de Broglie και την αρχή της απροσδιοριστίας του Heisenberg, οδήγησε στην ανάπτυξη της σημαντικότατης θεωρίας της κυματομηχανικής, που είναι περισσότερο γνωστή ως κβαντομηχανική.
Τι είναι τελικά το ηλεκτρόνιο; Σωματίδιο ή κύμα;
Η φύση του ηλεκτρονίου είναι μία, δεν αλλάζει συνεχώς. Δεν είναι ούτε σωματίδιο, ούτε κύμα, αλλά μια σύνθεση που εμπεριέχει ταυτόχρονα και τις σωματιδιακές και τις κυματικές ιδιότητες.
Το ηλεκτρόνιο είναι μεν σωματίδιο αλλά δεν ακολουθεί κάποια τροχιά, όπως γίνεται στη Κλασική Μηχανική. Πώς θα περιγράψουμε λοιπόν την κίνηση του;
Για την περιγραφή του ηλεκτρονίου χρησιμοποιείται μία κυματοσυνάρτηση, που συμβολίζεται με Ψ που εξαρτάται από τη θέση και το χρόνο και συμφιλιώνει τη σωματιδιακή και την κυματική φύση. Η κυματοσυνάρτηση Ψ που περιγράφει ένα κύμα ύλης, δεν έχει φυσικό νόημα.
Κύμα πιθανότητας στην Κβαντική Θεωρία. Η στατιστική ερμηνεία της κυματικής φύσης των ηλεκτρονίων:
Τα κύματα της κυματομηχανικής που παριστούν τη γνώση μας για τα ηλεκτρόνια, είναι μαθηματικές νοητικές επινοήσεις και διαδίδονται σε εννοιολογικούς χώρους. Τα κύματα των ηλεκτρονίων είναι κύματα πιθανότητας, όπου η ένταση των κυμάτων σε κάθε σημείο δίνει ένα μέτρο της πιθανότητας να εμφανιστεί ένα ηλεκτρόνιο σ’ αυτό το σημείο. Τα κύματα αυτά δε μεταφέρουν ούτε μάζα ούτε ενέργεια και δεν έχουν εννοιολογική σημασία, αφού δεν είναι συστατικά της φύσης, αλλά δημιουργήματα των προσπαθειών μας να ερμηνεύσουμε τη φύση.
Που είναι τελικά τα ηλεκτρόνια;
Η ίδια η κυματοσυνάρτηση Ψ δε μας λέει τίποτα γι’ αυτό. Ωστόσο αν πάρουμε το τετράγωνο της, δηλαδή |Ψ|2, τότε βρίσκουμε μια κατανομή πιθανότητας.
Η κβαντική θεωρία περιγράφει τη συμπεριφορά των σωματιδίων μέσω κατανομών πιθανότητας. Για παράδειγμα η θέση που μπορεί να έχει ένα σωματίδιο μπορεί να είναι οπουδήποτε έτσι δημιουργείται η εντύπωση ότι η φύση είναι αβέβαιη και τα πάντα επιτρέπονται. Ωστόσο αν ο αριθμός των σωματιδίων είναι τεράστιος η μέση τιμή των θέσεων δίνει μία κατανομή πιθανοτήτων με βάση την οποία η θέση του σωματιδίου μπορεί να προβλεφθεί.
Η απάντηση αυτή είναι ίσως αόριστη για να διαλευκάνει το μυστήριο. Θυμίζει τη φράση Γάλλου πεζογράφου «Όταν σου αποκρίνεται ένας φιλόσοφος, δεν καταλαβαίνεις πια καθόλου τι τον είχες ρωτήσει».
1932
James ChadwickΑνακάλυψε το νετρόνιο
Το 1932 ένας φοιτητής του Ernest Rutherford, ο Άγγλος φυσικός James Chadwick ανακάλυψε την ύπαρξη του νετρονίου, συμπληρώνοντας την εικόνα μας για τα υποατομικά σωματίδια που συνθέτουν ένα άτομο.
Η ιστορία δεν τελειώνει ούτε εκεί. Από τότε έχει ανακαλυφθεί ότι τα υποατομικά σωματίδια αποτελούνται από μικρότερα σωματίδια, όπως είναι τα μεσόνια, ποζιτρόνια, νετρίνο, quarks κτλ.
Είναι επίσης σημαντικό να αναγνωρίσουμε ότι μπορεί το μοντέλο που θεωρούμε εμείς σήμερα αποδεκτό να είναι λάθος. Ο μόνος τρόπος να μπορέσουμε να είμαστε σίγουροι είναι να συνεχίσουμε να θέτουμε ερωτήσεις και να διεξάγουμε πειράματα.
Η ατομική θεωρία, όπως τη γνωρίζουμε σήμερα, είναι προϊόν εκατοντάδων, αν όχι χιλιάδων, διαφορετικών ιδεών. Όλοι οι ερευνητές που αναφέρθηκαν είναι μόνο μερικοί από τους επιστήμονες που συνέβαλαν. Το άτομο μας δίνει ένα μεγάλο παράδειγμα του τρόπου με τον οποίο «οικοδομείται» η Επιστήμη. Όπως έχει πει ο Sir William L. Bragg «Στην επιστήμη μία λάθος θεωρία είναι πολυτιμότερη και καλύτερη από καμία θεωρία».
--
Πηγή:
Στυλιανός Λιοδάκης. Εφαρμοσμένη Ανόργανη Χημεία. 2003 Παρισιάνου Α.Ε.
